 مکانیسم درد درد نرمال یا فیزیولوژیک به عنوان یک سیستم هشدار دهنده به فرد درباره وجود محرک آزار رسان در محیط عمل میکند.بخاطر اینکه این نوع درد به علت آسیب بافتی و التهاب آغاز میشود اغلب به عنوان درد نوسیسپتیو یا التهابی شناخته میشود.اگر پروسه بیماری در فرد کنترل شوددرد نوسیسپتیو متوقف میشود.درمقابل درد نروپاتیک به علت مشکلات فانکشنال در سیستم عصبی بروز میکند وممکن نیست ربطی به آسیب بافتی محیطی داشته باشد.درد نروپاتیک به عنوان درد پاتوفیزیولوژیک شناخته میشود ومدت طولانی بعد از اینکه پروسه ترمیم بافت به پایان میررسد ادامه میابد.درحالیکه درد نوسیسپتیو به عنوان یک مکانیسم حفاظتی بر علیه آسیب بالقوه بافتی عمل میکند به نظر میرسد که درد نروپاتیک فاقد هر فایده ای برای بیمار باشد و اعتقاد وجود دارد که دردنروپاتیک معرف یک پروسه فیزیولوژیک ناسازگار است. مکانیسم درد نوسیسپتیو از اساس با مکانیسم درد نروپاتیک متفاوت میباشد.سیستم انتقال نوسیسپتیودر ارتباط با پاسخ به محرک آزار رسان میباشد ومستلزم وجود سیستم عصبی سالم است که دارای فانکشن نرمال باشد.درد نروپاتیک نیازی به محرک آزاررسان ندارد اما نیاز به وجود عصب صدمه دیده یا سیستم عصبی مرکزی و/یا محیطی دارد که عملکرد غیر نرمالی داشته باشد.به عبارت دیگر درد نوسیسپتیو نیاز به فعالیت نوسیسپتور دارد درحالیکه درد نروپاتیک چنین نیازی ندارد.با وجود این درد نوسیسپتیو و درد نروپاتیک میتوانند در برخی مکانیسمهای پایه ای اشتراکاتی داشته باشند که در ادامه در مورد آن توضیحاتی داده میشود. مکانیسم درد نوسیسپتیو پروسه انتقال درد ازمحیط به مراکز بالاتر در مغز یک پروسه پویا میباشد وطی آن انتقال پیام درد میتواند : به صورت کامل سرکوب شود(بی حسی) ، بدون تغییر رله شود یا اینکه تشدید گردد(هایپر آلژزیا). دکتر فیلد پروسه درد را از آغاز آن در وارد شدن محرک به بافت آسیب دیده تا تجربه سابژکتیو درد به مراحل زیر تقسیم کرده است: Transduction: پروسه ای که محرک آزاررسان در انتهای عصب حسی مربوطه تبدیل به فعالیت الکتریکی (ایمپالس عصبی) میشود Transmission: پروسه انتقال ایمپالس عصبی به کورتکس مغزی میتواند به سه مرحله اصلی تقسیم شود:1) انتقال ایمپالس عصبی از محل ترانسداکشن به قسمت انتهایی در trigeminal brain stem complex(شاخ پشتی طناب نخاعی)،2)رله پیامها از trigeminal brain stem complex به سایر نواحی ساقه مغز و تالاموس و3)اتصالات رسیپروکال بین تالاموس و کورتکس مغزی Modulation: این پروسه با تغییر فعالیت عصبی مربوط است و منجر به کنترل بر روی نرونهای انتقال دهنده درد میشود .مودولیشن میتواند منجر به مهار،کاهش یا تشدید سیگنال نوسیسپتیو به مراکز بالاتر مغز گردد Perception: وقتی اطلاعات درد در مراکز بالاتر مغز دریافت میشود منجر به پاسخ های رفتاری درد و رنج میگردد شکل یک:اجزائ تجربه درد.
TRANSDUCTION انتقال اطلاعات از یک نرون به نرون دیگر نیاز به ایجاد سیگنال الکتریکی یا ایمپالس عصبی بوسیله سلول عصبی دارد.وقتی یک محرک آزاررسان بر روی یک نوسیسپتور واقع بر انتهای محیطی نرون آوران اولیه عمل میکند محرکهای شیمیایی و فیزیکی مختلف از طریق ترانسداکشن تبدیل به ایمپالسهای عصبی میشوند.این ایمپالس عصبی الکتریکی بنام اکشن پتانسیل یا پتانسیل عمل شناخته میشود. اکشن پتانسیل: اکشن پتانسیلها از طریق پروسه دپولاریزاسیون در محل آسیب ایجاد میگردند. برای فهم این پروسه ضروری است که درمورد فیزیولوژی سلولهای عصبی اطلاعات پایه ای را داشته باشیم. قسمت بیرونی سلول عصبی توسط غشائی که از لیپوپروتئین تشکیل شده احاطه شده است.درحالت استراحت، شارژ الکتریکی در عرض غشائ سلولی ثابت نگهداری میشود.این شارژ به عنوان resting membrane potential شناخته میشود که بوسیله وجود یونهای سدیم(NA+) و کلراید (CL-) در بیرون غشائ سلولی و یون پتاسیم (K+)در داخل سلول حفظ میشود.غلظت نسبی این یونها در هر سمت غشائ منجر میشود که شارژ سلولی در خارج مثبت و در داخل منفی باشد.بخاطر اینکه شارژ الکتریکی در بیرون از سلول به صورت اختیاری صفر در نظر گرفته میشود داخل سلول عدد منفی است(-70mv). در غشائ سلولی کانالهای یونی مختلفی وجود دارد که به صورت انتخابی اجازه نفوذ یونها را میدهند.این کانالها به عنوان کانالهای voltage gated" طبقه بندی میشوند که به مفهوم این است که بوسیله تغییر در resting membrane potential کانالها بین وضعیت باز یابسته قرار میگیرند.باز شدن کانال نفوذ پذیری یونها را افزایش میدهد و بسته شدن کانال نفوذ پذیری را کاهش میدهد کانالهای سدیمی Voltage-gated به صورت نرمال در انتهای محیطی نوسیسپتورها دیده میشوند.با آسیب بافتی تعداد این کانالهای سدیمی افزایش پیدا میکند.وقتی یک محرک آزار رسان در انتهای محیطی یک اکسون عمل میکند برخی از کانالهای سدیمی باز شده و اجازه ورود سدیم را به داخل سلول میدهند.همانطور که شارژ داخل سلول مثبت تر میگردد کانالهای سدیمی بیشتری باز شده واجازه نفوذ پذیری بیشتری به سدیم داده و سدیم بیشتری بداخل سلول وارد میشود.با تاخیر وبعد از باز شدن کانالهای سدیمی،کانالهای پتاسیمی باز شده و اجازه خروج پتاسیم از سلول را میدهند.نتیجه نهایی معکوس شدن قطبیت غشائ عصب میباشد و باعث میشود که دارای شارژ مثبت تری نسبت به resting membrane potential داشته باشد. برای اینکه یک محرک آزاررسان ایجاد اکشن پتانسیل در الیاف A دلتا وC کند باید از قدرت کافی برای تحریک انتهای آزاد عصبی تا حد آستانه ای که ایمپالس عصبی را آغاز کند برخوردار باشد.یک اکشن پتانسیل تنها وقتی رخ میدهد که پتانسیل غشائ به یک سطح کریتیکال خاص بنام threshold potential یا generator potential برسد.اگر پتانسیل غشائ به سطح کریتیکال یا بحرانی نرسد ایمپالس نوسیسپتیو ایجاد نمیشود.فرکانس Firing مستقیما مربوط شدت محرک و نوع خاص فیبر عصبی آوران درگیر دارد.تحت حالات فیزیولوژیک نرمال نیشگون محکم و پیوسته الیاف CوA دلتا را فعال میکند وبه پتانسیل آستانه میرسد تا اکشن پتانسیل ایجاد کند.در مقابل فیبرهای A بتا که تنها به لمس خفیف (light touch) پاسخ میدهند علی رغم مالش پیوسته به پتانسیل آستانه نمیرسند و تولید اکشن پتانسیل نمیکنند.زمانیکه اکشن پتانسیل یا ایمپالس عصبی ایجاد شد از طریق پروسه دپولاریزاسیون در طول آکسون حرکت میکند. شکل دو:تولید اکشن پتانسیل
بهرحال اگر رسپتورها بوسیله تروما یا التهاب روبه پیشرفت حساس شوند(سنسیتیزاسیون نوسیسپتور یا محیطی) پتانسیل آستانه ممکن است به سطحی کاهش یابد که اجازه دهد تحریکات نسبتا بی ضرر مانند لمس خفیف درد ایجاد کنند.تحت این شرایط الیاف A بتا اکنون توانایی انتقال اطلاعات نوسیسپتیو را دارند.وقتی این حالت رخ میدهد به عنوان آلودینیا شناخته میشود )آلودینیا میتواند به عنوان ایجاد درد در اثر محرکی که در حالت نرمال نمیتواند باعث برانگیختن درد شود تعریف گردد).برای ذکر مثالی از این وضعیت میتوان به دردی اشاره کرد که که توسط مالش بر روی نواحی از پوست که دچار آفتاب سوختگی شده اند ایجاد میگردد. بلوک کننده های کانالهای سدیمی اگر چه به نظر میرسد چندین کانال یونی محیطی در انتقال نوسیسپتیو نقش داشته باشند اما تنها داروهای بلوک کننده کانالهای یونی سدیمی که باعث مهار ورود سدیم بداخل سلول میشوند در حال حاضر موجود میباشند.بدون ورود یون سدیم بداخل سلول اکشن پتانسیل ایجاد نخواهد شد حتی اگر محرک آزار رسان وجود داشته باشد.مدارکی وجود دارد که نشان میدهدآپ رگولیشن غیرنرمال کانالهای سدیمی در پاتوفیزیولوژی درد نروپاتیک کمک کننده است.چندین دارو که به عنوان بلوک کننده کانالهای سدیمی شناخته میشوند به صورت کلینیکی برروی دردهای نروپاتیک تاثیر دارند .این داروها از طریق بلوک کانالهای سدیمی ( که سبب ساپرس (کاهش) دیسشارژ غیرنرمالی که در محل آسیب عصبی ایجاد میشود) بر روی درد نروپاتیک تاثیر میگذارند. برای مثال تزریق بی حسی های موضعی شبیه لیدو کائین یا داروهای خوراکی ضد آریتمی مکسیتیلین میتوانند به صورت بالقوه از طریق بلوک کانالهای سدیمی مانع از اکشن پتانسیل تولید کننده درد شوند.کاربامازپین که یک داروی ضد صرع میباشد و به وفور برای درمان نورالژی تری ژمینال مورد استفاده واقع میشود اثرش را از طریق ممانعت از ورود یونهای سدیم بداخل سلول ایفا میکند.داروی دیگری که به صورت رایج در درمان دردهای نروپاتیک استفاده میشود آمی تریپتیلین میباشد که یک آنتی دپرسان سه حلقه ای میباشد.خصوصیت ضد دردی آنها به علت توانایی آنها برای بلوک کانالهای سدیمی و ممانعت از بازجذب سروتونین و نوراپینفرین میباشد.به صورت جالبی بلوک کننده های کانال سدیمی تنها بر روی کانالهای سدیمی بیش فعال اثر میگذارند و اثری بر روی کانالهای سدیمی نرمال ندارند .به عبارت دیگر این داروها باعث گسست درانتقال ایمپالسهای نرمال در سرتاسر بدن نمیشوند. کانالهای سدیمی TTX-R با وارد شدن آسیب تعداد کانالهای سدیمی در انتهاهای محیطی افزایش پیدا میکند که باعث کاهش آستانه تولید اکشن پتانسیل میگردد و نقش مهمی در تحریک پذیری بیش از حد نرونهای حسی دارد که به ایجاد درد نروپاتیک کمک میکند.بیش از ده نوع مختلف از کانالهای سدیمی voltage-gated شناسایی شده است .این کانالهای سدیم بر اساس حساسیتشان به تترودوتوکسین که یک نروتوکسین آلکالوئید میباشد(ودر ماهی های پوفر و قورباغه های گرمسیری تولید میشود) به لحاظ فانکشنال از هم متمایز میشوند.بر اساس تفاوتهای فارماکولوژیک ، کانالهای سدیمی میتوانند به دو دسته داروهای حساس به TTX وداروهای مقاوم به TTX تقسیم میشوند. جریانهای تولید شده در کانالهای یونی TTX-R اساسا در الیاف درگیر در نوسیسپشن مثل الیاف C و الیاف A دلتا پیدا میشوند.فعالیت کانالهای سدیمی TTX-R جریانی را ایجاد میکند که به آهستگی غیر فعال شده وبنابراین باعث اکشن پتانسیل های طولانی و مکرر میگردد و همراه با آسیب بافتی فعالیت نوسیسپتور حفظ میگردد.مولکولهای التهابی مانند پروستاگلندین ها و سروتونین میتوانند جریان کانالهای سدیمی TTX-R را درنرونهای گنگلیون تری ژمینال (گنگلیون ریشه پشتی)تنظیم کنند.اگرچه در حال حاضر عامل دارویی در دسترس نیست که مستقیما جریان را در TTX-R تحت تاثیر قرار دهد فعالیت محیطی بلوک کننده های کانالهای سدیمی و همچنین ترکیبات ساپرس کننده سروتونینی و پروستاگلندینها ممکن است فعالیت در کانالهای سدیمی TTX-R را کاهش میدهد. هایپر پولاریزاسیون یک اکشن پتانسیل معرف تغییر موقت در resting membrane potential نرون میباشد.بدنبال یک اکشن پتانسیل یک دوره مختصر هایپر پولاریزاسیون ایجاد میشود که در آن resting membrane potential بیشتر سلولهای عصبی به صورت مشخصی منفی میگردد. این امر بدلیل غیر فعال شدن کانالهای سدیمی ،ورود یونهای کلراید منفی و ادامه خروج یونهای K رخ میدهد.وقتی هایپرپولاریزاسیون رخ میدهد سلول در یک دوره refractory قرار میگیرد و هیچ اکشن پتانسیلی نمیتواند ایجاد گردد.بهرحال در میان یک دوره زمانی خیلی کوتاه سلول رپولاریزه شده به resting membrane potential میرسد. داروهایی مانند بنزودیازپینها و باربیتوراتها میتوانند هایپرپولاریزاسیون را ایجاد کنند.بنزودیازپینها به محل رسپتورهای خاصی در غشائ عصبی متصل شده و affinity غشائ را برای GABA مهاری ترشح شده بوسیله اینترنرونها افزایش میدهد.این افزایش اتصال GABA اجازه میدهد یونهای کلراید بیشتری داخل سلول عصبی شوند و داخل سلول را بیشتر منفی کنند و منجر به هایپرپولاریزاسیون شوند. Neurochemistry of Transduction بدنبال آسیب بافتی ترکیبات التهابی مختلف که اغلب به عنوان آبگوشت التهابی نامیده میشود در انتهای عصب محیطی رها شده وفیبرهای آوران اولیه را فعال میکند.مدیاتور التهابی اولیه پلی پپتید برادی کینین میباشد که از پروتئینهای پلاسما رها میشود.آسیب به دیواره سلولی منجر به رهایی اسید آراشیدونیک شده که توسط سیستم های آنزیمی مختلف پروسس شده و تولید دو مدیاتور التهابی دیگر بنام پروستاگلندین و لکوترین میکند.برادی کینین به صورت سینرژیستیک با این دو مدیاتور التهابی و هیستامین و سروتونین عمل میکند تا خروج پلاسما و ادم را افزایش دهد.درحالیکه پلاسما اکستراوازیشن(خروج پلاسما) باعث ورود مجدد مدیاتورهای التهابی برای ایجاد مکانیسم فیدبک میگردد به ترمیم بافت آسیب دیده توسط تشویق درناژ وریدی و لنفاوی مدیاتورهای التهابی نیز کمک میکند. شکل سه:ارتباط بین مدیاتورهای التهابی که در حین التهاب ایجاد میگردد
نروتروفینها مانند فاکتور رشد عصبی(NFG) بواسطه فعال کردن ماست سلها نقش مهمی در پروسه التهابی ایفا میکنند.ماست سلها هیستامین و سروتونین را رها میکنند که به صورت غیر مستقیم به سنسیتیزاسیون محیطی کمک میکند که یک پروسه مهم در تشدید درد در محل آسیب میباشد.مدیاتورهای التهابی از جمله NGF رهایی نوروپپتیدها (سوبستانس پی،و CGRP را که در اجسام سلولی نرونهای آوران اولیه (الیاف C)(قرار گرفته در گنگلیون تری ژمینال یا معادل نخاعی آن یعنی گنگلیون ریشه پشتی ساخته شده اند)تشدید میکنند. سوبستانس پی و CGRP میتواند از جسم سلولی به CNS(ارتودرومیکالی) از طریق سیستم انتقالی اکسون منتقل شوند یا اینکه به دور از CNS به سمت محیط(آنتی درومیکالی) که برخلاف جهت نرمال ایمپالسها است منتقل گردد.در CNS این نروپپتیدها به سنترال سنسیتیزاسیون کمک میکنند پروسه ای که در برخی سندرمهای درد مزمن نقش دارند.فعالیت آنتی درومیک سبب رهایی SP و CGRP در انتهای محیط در محل آسیب میگردد.رهایی این مواد دردزا به عنوان التهاب نروژنیک شناخته میشود ومنجر به حساسیت نرونهای مجاور در ناحیه میگرددو همچنین سبب وازودیلاتاسیون موضعی و ادم میگردد. سیستم عصبی سمپاتیک از طریق رهایی نوراپینفرین از الیاف وابران پست گنگلیونیک در التهاب نقش دارد.نوراپینفرین نفوذپذیری عروق و اکستراوازیشن پلاسما را تشدید کرده وباعث افزایش در رهایی مدیاتورهای التهابی میگردد.
TRANSMISSION پروسه ترانسمیشن شامل هدایت اکشن پتانسیل از محل ترانسداکشن به نرون های ثانویه در ساب نئوکلئوس کادالیس(که در trigeminal brain stem complex قرارگرفته است) گفته میشود.در اولین سیناپس اکشن پتانسیل دیگری ایجاد میگرددکه به مراکز بالاتر در مغز منتقل میشود.بخاطر اینکه اکشن پتانسیلها معمولا فاصله زیادی را طی میکنند هماهنگ کردن اکشن از دو نوع جریان رایج مورد نیاز است جریان اکتیو و جریان پاسیو.افزایش قطر اکسون مقاومت داخلی را برای جریان پاسیو کاهش میدهد طوری که سرعت هدایت را افزایش میدهد.به صورت مشابه پوشش اکسون با میلین باعث افزایش سرعت جریان پاسیو اکشن پتانسیل میشود چرا که میلین باعث عایق سازی اکسون شده و مانع از هر گونه نشت جریان میگردد.در گپ هایی که در غلاف میلینی ایجاد میشود و بنام گره رانویر شناخته میشود اکشن پتانسیل هایی به صورت فعال ایجاد میگردند که درراستای هدایت جریان در طول آکسون عمل میکند. ارتباطات بین نرونها در سیناپس رخ میدهد که به عنوان یک نقطه رله عمل میکند و نرونهارا قادر میسازند که اطلاعات را از یک نرون به دیگر منتقل کنند.یک نرون در CNS قادر است هزاران اتصال را از سایر نرونها دریافت کند.تمام سیناپسها اعصاب حسی در CNS رخ میدهد.وقتی سیناپس در بیرون از CNS رخ میدهد یک پدیده غیرنرمال است و به عنوان ephapse شناخته میشود.این پدیده وقتی رخ میدهد که آسیب باعث گسست در آکسون نرونهای مجاور گردد. Second-order Neurons زمانیکه سیگنال نوسیسپتیو تولید میشود به سمت محل سیناپس با Second-order Neurons در ساب نئوکلئوس کادالیس حرکت میکند جایی که اکشن پتانسیل دیگری تولید شده و اطلاعات نوسیسپتیو را به مراکز بالاتر CNS میفرستد.این نرونهای ثانویه به صورت عمده نرونها ی Wide dynamic range (WDR) میباشندکه به هر دو محرک آزار رسان و غیر آزار رسان پاسخ میدهند ونرونهای nociceptive specific (NS) که به محرک آزار رسان پاسخ میدهند.بعلاوه نرونها low threshold mechanoreceptor (LTM) نیز وجود دارند که به محرکهای غیر آسیب رسان پاسخ میدهند. نرونهای WDR اکثر نرونهای ثانویه در ساب نئوکلئوس کادالیس را میسازند و به صورت معمول اینپوت نوسیسپتیو را از الیاف A دلتا والیاف C و اینپوتهای غیر آزار رسان را از الیاف A بتا دریافت میکنند.نام Wide dynamic range (WDR) این نرونها از این حقیقت منشائ میگیرد که اینپوتهای الیاف اولیه اوران اولیه در پوست ،عضله و ارگانهای ویسرال در این نرونها همگرا شده و این توانایی را دارند که به رنج وسیعی از محرکها با شدت مختلف پاسخ دهند.وقتی نرونهای WDR بوسیله محرک دردناک فعال میشود آنها ممکن است حساس شوند(سنترال سنسیتیزاسیون) و منجر به گسترش میدان پذیرش و انتشار درد شوند. همچنین در میان ساب نئوکلئوس کادالیس اینترنرونهایی وجود دارد که با دیگراینتر نرونها برای تشکیل یک شبکه مرتبط میشوند.برای مثال اینترنرونهای projection مسئول انتقال اطلاعات نوسیسپتیو از ساب نئوکلئوس کادالیس به مراکز بالاتر مغز میباشند.همچنین اینترنرونها اطلاعات را به رفلکس موتونرونها منتقل میکنند و منجر به پاسخ رفلکسی به نوسیسپشن میگردند مثل پس کشیدن دست از تماس با شعله داغ. وقتی درد احساس میشود بدن بوسیله حفاظت خودش از آسیب بافتی بیشتر از طریق پاسخهای فیزیولوژیک مناسب مختلف پاسخ میدهد.افزایش در تحریک پذیری نرونهای ثانویه تری ژمینال منجر به تشدید عملکرد حسی مانند هایپر آلژزیا ثانویه و آلودینیا میگردد.هایپر آلژزیا به صورت افزایش پاسخ دردناک به محرکهایی که در حالت عادی دردناکند گفته میشود و آلودینیا پاسخ دردناک به محرکی که در حالت عادی انتظار نمیرود منجر به درد گردد.اما هایپر آلژزیا و آلودینیا میتواند در محل آسیب از طریق حساسیت نوسیسپتورهای محیطی رخ دهد .این امر به عنوان هایپر آلژزیا اولیه و آلودینیا اولیه شناخته میشود این پاسخ های تسهیل کننده درد(هایپر آلژزیا و آلودینیا) آگاهی شخص را نسبت به وضعیت بیشتر میسازد و فرد را تشویق به پاسخ هایی مثل گارد گرفتن و ثابت نگه داشتن بافت آسیب دیده میکند و آنرا از آسیب بیشتر محافظت میکند.بهرحال تحت شرایط خاص مغز میتواند وارد حالت بقا گردد و به طور کامل انتقال و دریافت درد را از طریق فعالیت سیستم مهاری داخلی درد متوقف کند.مثال رایج در این باره سربازی است که درجنگ به وظایف خودش علی رغم اینکه زخمی شده عمل میکند یا ورزشکاری که به مسابقه ادامه میدهد علی رغم اینکه مصدوم شده است. MODULATION همچنانکه ایمپالسهای عصبی در طول عصب به سمت مراکز بالاتر حرکت میکنند ایمپالسها تحت تاثیر تنظیم کننده های مختلف که میتوانند تحریکی یا مهاری باشند قرار میگیرند.در راستای کوشش برای توضیح این پیچیدگی pain modulation دکتر ملزاک و دکتر وال تئوری Gate control theory را درسال 1965 ارائه کردند.در آن زمان این تئوری منحصر بفرد بود و معرف یک گسست بزرگ در افکار قدیمی بود.اگرچه تئوری Gate control در سالهای گذشته دچار تغییراتی شد اما فرضیه اصلی آن در طول زمان ثابت مانده است Gate Control Theory این فرضیه پیشنهاد میکند که مکانیسم عصبی در ساب نئوکلئوس کادالیس (شاخ پشتی نخاع) شبیه به یک دروازه عمل میکند تا انتقال ایمپالسهای عصبی را از محیط به مغز افزایش یا کاهش دهد.این دروازه یک ناحیه ای را تعریف میکند که محل پایانی تعداد زیادی از الیاف آوران اولیه ،اینترنرونهای متعدد، و الیاف نزولی از مراکز بالاتر CNS میباشد وقتی سیگنال نوسیسپتیو به دروازه میرسد این سیگنالها بوسیله سیگنالهای عصبی نزولی از ناحیه کورتیکال که در راستای تشدید یا کاهش شدت سیگنالهای نوسیسپتیو ی که از محیط وارد شده اند تعدیل میگردند.تعاملات پیچیده بین اعصاب آوران اولیه غیر میلینه ومیلینه در این محل رخ میدهد تا ایمپالسهای نوسیسپتیو را تغییر دهد.تعیین این که آیا این اکشن پتانسیل مسیرخود در تریژمینوتالامیک(اسپاینوتالامیک) بدون تغییر ادامه دهد یا از شدت آن کاسته شود یا اینکه به شدت آن افزوده گردد بوسیله حاصل جمع عملکرد نوروترانسمیترهای مهاری و تحریکی بر روی سیناپس نرون اولیه با نرون ثانویه،NS ، WDR تعیین میگردد. شکل چهار:توصیف این ناحیه به عنوان دروازه نمادی از نتیجه خالص اثرات مهاری و تحریکی بر روی نرون ثانویه یا سلولهای انتقالی است(T ).نروترانسمیترهای متعدد بر روی سلول T عمل میکنند وسرنوشت سیگنال نوسیسپتیو را تعیین میکنند.اگر سیگنال نوسیسپتیو مهار نشود از میان دروازه عبور کرده تا به مراکز بالاتر منتقل شود اگر تعامل نرونها سیگنال نوسیسپتیوررا لغو کند آن سیگنال از میان دروازه عبور نمیکند.الیاف نوسیسپتیو کوچک (الیاف C غیرمیلینه و الیاف A دلتا با میلین ضعیف) اثر تحریکی بر روی سلول T دارند.I اینترنرون مهاری است که به صورت فعال سلول T را مهار میکند.وقتی نرون مهاری I بوسیله الیاف (A بتا) غیر نوسیسپتیو بزرگ تحریک شود آن باعث رها شدن نوروترانسمیترهای مهاری بر روی سلول T میگردد که سیگنال نوسیسپتیو را متوقف میکند.
به صورت خلاصه مکانیسم GATE بوسیله ایمپالسهای عصبی که از مغز نزول میکنند و ایمپالسهایی که از محیط به سمت مغز صعود میکنند تخت تاثیر قرار میگیرد .در حالیکه فعالیت فیبرهای آوران کوچک ) A-delta, C-fibers ) عموما دروازه را باز میکنند و انتقال را تسهیل میکنند اینپوت الیاف آوران بزرگ (A-beta) مایل است که دروازه را ببندد و انتقال را مهار کند.یک مثال اثر تیپیک مالش بر روی ناحیه دردناک میباشد که بدنبال تروما برای کاهش درد صورت میگیرد.مالش غیر آزار رسان است و بواسطه الیاف A بتا منتقل میشود و باعث فعال شدن یک اینترنرون مهاری میگردد تا انتقال درد را کاهش دهد.اثرات تسکینی درد در روش transcutaneous electrical nerve stimulation (TENS) میتواند توسط تئوری گیت کنترل توضیح داده شود چرا که تحریک الیاف A بتا پوستی میلینه و غیرنوسیسپتیو دارای اثرات تسکینی میباشد اما اهمیت تئوری gate control theory بسیار بیشتر از مثال بالاست.از تمام تئوری های درد تئوری gate control theory بیشترین اثر را بر روی درمان درد مزمن داشته است.با توجه به نقش پویا مغز در تنظیم درد از طریق پروسه های نزولی تئوری gate control theory اهمیت نقش فاکتورهای سایکولوژیک را در تجربه درد مورد توجه قرار داد .از نقطه نظر کلینیکی این تئوری برای cognitive behavioral therapy دلیل عقلانی ارائه میکند.همچنین بیماران قادرند که درک کنند که چگونه آنها میتواننددردشان را از طریق تکنیکهای حواسپرتی و فعالیتهای خوشایند کاهش دهند.همچنین به عنوان نتیجه این روش جدید جهت کنترل درد استفاده از تکنیکهای پزشکی و جراحی تهاجمی برای کاهش درد کاسته شده است . Descending Pain Modulating System مشخص شده است که خود مغز میتواند پردازش اطلاعات نوسیسپتیو را تنظیم کند و منجر به مهار یا تسهیل درد گردد.وقتی منبع تعدیل، مراکز بالاترمغز میباشد مسیرهای مختلف درگیر به صورت یکجا به عنوان descending pain modulating system نامیده میشود.شکل (5). این نام از این حقیقت منشائ گرفته است که نرونهایی که از ساقه مغز منشائ میگیرند برای اعمال اثرشان در سطح ساب نئوکلوئوس کادالیس وشاخ پشتی طناب نخاعی نزول میکنند .اگر اطلاعات نوسیسپتیو به کورتکس نرسد دریافت یا تجربه دردی به وقوع نمیپیوندد. بهرحال اینپوتهای نوسیسپتیو در این سطوح میتوانند تشدید شوند. شکل پنج: descending pain modulating system .اثرات تعدیل کننده پیچیده ای در هریک از این محلها از جمله شاخ پشتی (ساب نئوکلئوس کادالیس) رخ میدهد
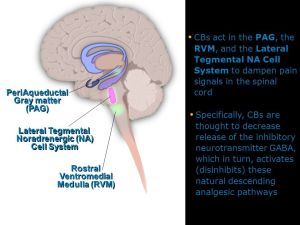
مکانیسمهای نزولی شبکه عصبی تهیه میکنند که اجازه میدهد ابعاد شناختی،عاطفی و attentive تجربه درد انتقال نوسیسپتیو درد را تحت تاثیر قرار دهد.مطالعات نشان دادند که انتظارات در مورد درد (عواقب درد) اهمیت ویژه ای در مورد تعیین اثرات descending pain modulating system دارد .انتظار بیهوشی یا بی دردی اثرات مهاری سیستم نزولی را تغییر(افزایش) میدهدو در حالیکه انتظار هایپر آلژزیا به صورت کامل اثرات مهاری سیستم نزولی را کاهش میدهد.سیستم تعدیل کننده ترکیبی است از سه جزئ اصلی در ساقه مغز که عبارتند از periaqueductal gray (PAG) که در midbrain, قرار گرفته است ، rostral ventral medulla (RVM) و سیستم اندوژنوز اپیوئیدی تشکیل شده است. The PAG/RVM System عمل اولیه سیستم تعدیل کننده PAG/RVM خاصیت آنتی نوسیسپتیو میباشد .این اثر وقتی حاصل میشود که مسیرهای نزولی فعال شده و سیگنالهای نوسیسپتیو را در اولین سیناپس با نرون ثانویه در ساب نئوکلئوس کادالیس (شاخ پشتی نخاع) کاهش میدهند .از PAG مسیرهایی به هسته های مختلف در RVM نزول میکند و سبب رهایی مونوآمینهای مهاری،سروتونین و نوراپینفرین میشوند. منبع اصلی سروتونین هسته رافه مگنوس میباشد،لوکوس سرولوس به عنوان منبع اصلی نوراپینفرین عمل میکند.همچنین تحریک مستقیم هسته های رافه مگنوس در مدولا رهایی سروتنونین را تحریک میکند.مطالعات حیوانی نشان داده است که این نواحی بعلاوه spinal tract of the trigeminal complex وقتی بوسیله اپیوئیدهای اگزوژنوز تحریک میشوند باعث ایجاد بی دردی میگردند .سیستم PAG/RVM بوسیله مهار رهایی نوروترانسمیترها(سوبستانس P) از نرونهای آوران اولیه باعث کاهش بیشتر نوسیسپشن میگردند. RVM یک منبع بویژه مهم تعدیل نزولی اینپوتهای آزاررسان از طریق دو کلاس از سلولها میباشد سلولهای ON و سلولهای OFF .وقتی فعال است سلولهای ON نوسیسپشن را تسهیل میکنند در حالیکه سلولهای OFF پردازش نوسیسپتیور ا کم میکنند..به صورت نرمال تعادلی بین این سلولها وجود دارد و آنها با یکدیگر برای کنترل تعدیل نزولی RVM ارتباط دارند.بهرحال تجویز ضد درد اپیوئیدی میتواند تعادل را به سمت سلولهای OFF تغییر دهد تا به صورت پیوسته فعال باقی بمانند و منجر به مهار پاسخهای نوسیسپتیوشوند.برعکس رسیدن پیوسته تحریکات آزار رسان فعالیت سلولهای ON را افزایش میدهد و سبب تسهیل انتقال درد میشود و همچنین منجر به اختلالات مزمن درد میشود بویژه زمانیکه آسیب عصبی وجود دارد. Endogenous Opioid Inhibitory System: اگر چه سیستم تعدیل کننده درد نزولی descending pain modulating system پیچیده است و به خوبی شناخته نشده است ،، واضح است که عوامل فارماکولوژیک مختلف، پروسه فیزیولوژیک و مداخلات سایکولوژیک میتوانند سیستم مهاری درد اندوژنوز را فعال کنند و از انتقال ایمپالسهای نوسیسپتیو از نوسیسپتور آوران اولیه به نرون ثانویه در trigeminal brain stem complex ممانعت کنند.مهمتربن مکانیسم داخلی سیستم endogenous opioid میباشد که شامل پپتیدهای اپوئیدی میباشد که به عنوان بخشی از سیستم کنترل درد داخلی بدن برای کاهش درد عمل میکند . این اپیوئید های اندوژنوز در پاسخ به محرک نوسیسپتیو رها شده و شامل انکفالین،دینورفین،و پپتیدهای مرتبط با بتا اندورفین میباشد.خصوصیات آنها قابل مقایسه با اپیوئید اگزوژنوزمانند مورفین و کدئین میباشد . پپتیدهای اپیوئیدی و رسپتورشان بر روی نرون اولیه پیش سیناپسی ونرون ثانویه پست سیناپسی در ساب نئوکلئوس کادالیس قرار گرفته اند(substantia gelatinosa شاخ پشتی نخاع).اما پپتیدهای اپیوئیدی و رسپتورهای آنها بر روی چندین سطح دیگر از descending inhibitory system از جمله شبکه PAG/RVM پیدا میشود.بنابراین وقتی سیگنالهای نوسیسپتیو صعودی در midbrain, با PAG بهم وصل میشود میتواند در این سطح بوسیله رسپتور اپیوئیدی که بی دردی را وساطتت میکنند مهار شوند.تمام اپیوئیدها اثرات ضد دردیشان را بوسیله کاهش یا مهار انتقال نوسیسپتیو انجام میدهند. آنها این کاررا بوسیله ممانعت از رهایی نوروترانسمیترهای تحریکی،سوبستانس پی و CGRP از انتهای نرونهای آوران اولیه انجام میدهند..درحالیکه اپیوئیدها در درجه اول در وضعیت درد حاد موثر هستند سروتونین و نوراپینفرین برای برطرف کردن درد مزمن عمل میکنند. باید توجه کرد که پروسه های تنظیمی مهم دیگری نیز از نوروترانسمیترها(گاما آمینوبوتیریک اسید و گلیسین) استفاده میکند.برخلاف سیستم اپیوئید اندوژنوز GABA بوسیله مهار رهایی سوبستانس پی عمل نمیکند.بلکه بیشتر سبب میگردد که کلراید داخل آکسونهای هدایت کننده نوسیسپتیو شده و منجر به هایپرپولاریزاسیون غشائ عصبی و مهار پتانسیل آکسون نوسیسپتیو میگردد سایر نواحی تنظیمی(تعدیل کننده) Other Modulatory Areas:
تعدیل بیشتر سیگنال نوسیسپتیو صعودی میتواند در مراکز بالاتر نیز رخ دهد .این امر از طریق یکسری تعاملات پیچیده بین نواحی تالاموس،هیپوتالاموس،لیمبیک و کورتکس رخ میدهد.در انجام این امر brain stem reticular formation که یک شبکه منتشر از اجسام سلولی است و در مدولا ،پل مغزی و midbrain قرارگرفته و اتصالات آن به طناب نخاعی،تالاموس،هیپوتالاموس،سیستم لیمبیک و شاید کورتکس ادامه یافته است نقش دارد.رتیکولار فورمیشن اثرش را بر روی سیگنالهای نوسیسپتیو صعودی اعمال میکند و عملش میتواند تحریکی یا مهاری باشد.رتیکولار فورمیشن احتمالا مسئول برانگیختگی عمومی میباشد که بوسیله درد ایجاد میشود و واکنش جنگ وگریز به وضعیتی است که فرد را تهدید کرده است.اعتقاد وجود دارد که ارتباطات دو طرفه بین رتیکولار فورمیشن و سیستم لیمبیک نقش مهمی در بعد motivational-affective درد ایفا میکند. نشان داده شده است استفاده از محرک ازار رسان در قسمتی از بدن میتواند درد را در قسمت دیگری از بدن مهار کند(pain-inhibits-pain).این پدیده بنام diffuse noxious inhibitory control’ (DNIC) شناخته میشد اما اخیرا بنام "conditioned pain modulation." نامیده میشود.برخلاف سیستم ضد دردی اندوژنوز نزولی که کنترل درد از بالا به پایین است DNIC معرف فعالیت پایین به بالا برای سیستم تنظیم درد است
PERCEPTION درک درد ادراک نقطه نهایی فعالیت عصبی اطلاعات نوسیسپتیو میباشد.تنها زمانی که این اطلاعات به مغز میرسند درد تبدیل به یک تجربه آگاهانه میشود.انتقال اطلاعات حسی از محیط به مغز به عنوان جزئ sensory-discriminative درد در نظر گرفته میشود.شبکه های پیچیده درد در پردازش درد نقش دارند وهنوز نامشخص است که کدام سیستم های عصبی ویژه مسئول تعامل و عمل بر روی این اطلاعات که به مغز منتقل شده است میباشد.بهرحال آشکار است که نواحی موجود در کورتکس سوماتوسنسوری عمدتا نقش اصلی را برعهده دارند اما محصول نهایی انتقال درد فقط درد نیست بلکه بعد motivational-affective درد نیز وجود دارد.بخاطر اینکه درد قطعا دارای کیفیت نا خوشایندی است و باعث میشود تقریبا تمام ملاحظات ونیازهای دیگرکنار رفته و توجه بلافاصله معطوف به توقف درد میگردد.بعد motivational-affective درد هست که شخص را به سمت فعالیتهایی سوق میدهد که درد اگر امکان دارد سریعتر متوقف شود.درد در حد بسیار زیادی یک تجربه شخصی میباشد که در اشخاص مختلف فرق میکند.پیشنهاد شده است که بعد cognitive-evaluative نیزدر درد وجود دارد که هر دو بعد sensory-discriminative و motivational-affective درد را تحت تاثیر قرار میدهد.تجربه درد عمیقا توسط فاکتورهای مختلف مثل یادگیری،اضطراب،مفهوم وضعیت توجه کردن به درد،مقداری از توجه که به درد داده میشود میتواند تحت تاثیر قرار گیرد.این فاکتورها مشخص میکند که آیا یک درد مداوم میتواند در حد زیادی با زندگی بیمار تداخل داشته باشد یا اینکه تنهاباعث آزار خفیفی برای بیمار میشود.برای کاهش ابعاد affective و sensory درد تکنیکهای cognitive-behavioral مختلفی مانند آموزش ریلکسیشن ،تشبیه سازی هدایت شده و انحراف از موضوع مورد استفاده واقع شده و درجات مختلفی از موفقیت را داشته اند. آسیب بافتی وقتی اسیب بافتی رخ میدهد یک آبگوشت پیچیده از مدیاتورهای التهابی آزاد شده و منجر به علائم اصلی ادم، درد، اریتم، حرارت و کاهش فانکشن میشوند .نتیجه دیگر آسیب بافتی هایپر آلژزیا و آلودینیا است.آلودینیا زیر مجموعه هایپر آلژزیا است.بخاطر اینکه هایپر آلژزیا و آلودینیا به طور معمول در بسیاری از حالات درد اوروفاسیال دیده میشود، فهم مکانیسم ایجاد کننده درد از نقطه نظر تشخیص ودرمان بسیار مهم است.اگر چه فهم ما از مکانیسم ایجاد این نوع دردها هنوز کامل نشده است ولی واضح است که این پدیده ها به علت سنسیتیزاسیونی sensitization است که به صورت محیطی و یا مرکزی رخ میدهد.هایپر آلژزیا معمولا به عنوان اولیه یا ثانویه تقسیم بندی میشود. سنسیتیزاسیون محیطی(نوسیسپتور) Peripheral (Nociceptor) Sensitization: عمل ساخت مدیاتورهای التهابی مختلف و رهایی آنها در محل آسیب بدنبال آسیب بافتی باعث افزایش واکنش نوسیسپتور اولیه به محرک حرارتی ،مکانیکی و شیمیایی در محل اول آسیب میگردد.این امر به عنوان سنسیتیزاسیون محیطی یا نوسیسپتیو شناخته میشود.این سنسیتیزاسیون به علت کاهش آستانه دپولاریزاسیون در انتهای عصبی نوسیسپتیو در محل آسیب میباشد که نتیحه آن هایپر آلژزیای اولیه است که گاهی اوقات به عنوان هایپر آلژزیای التهابی نیز شناخته میشود.بوسیله فراهم کردن سیگنالی که منجر به غیر متحرک شدن قسمت آسیب دیده میشود پریفرال سنسیتیزاسیون به عنوان یک مکانیسم دفاعی برای حفاظت بافت آسیب دیده از آسیب بیشتر عمل میکند. پروسه التهاب نروژنیک نقش اولیه در سنسیتیزاسیون محیطی ایفا میکند.التهاب نروژنیک مکانیسم بنیادی برای درد میباشد و شامل رهایی دومدیاتور برجسته و اصلی درد (سوبستانس پی و CGRP )از جسم سلولی الیاف C در گنگلیون تری ژمینال میباشد.اگر این نوروترانسمیترها به صورت آنتی درومیکالی به انتهای محیطی اعصاب آوران منتقل شوند سبب سنسیتیزاسیون محیطی میگردند.وقتی سوبستانس پی و CGRP به نرونهای ثانویه در CNS منتقل میشوند(ارتودرومیکالی) نقش مهمی در سنترال سنسیتیزاسیون ایفا میکنند. فاکتور دیگر در سنسیتیزاسیون محیط فعال شدن نوسیسپتورهای "sleeping or silent" میباشد.به صورت نرمال این اعصاب آوران غیر فعال هستند و به محرک مکانیکی پاسخ نمیدهند.بهرحال بدنبال آسیب بافتی آنها میتوانند فعال شوند و به صورت نسبی به محرک مکانیکی بی ضرر پاسخ دهند و بنابراین به اینپوت نوسیسپتیو به CNS اضافه کنند. سنسیتیزاسیون مرکزی سنسیتیزاسیون مرکزی پاسخ تشدید یافته CNS به محرک آزار رسان و محرک غیر آزار رسان است.مهم است که متوجه باشیم که CNS مشابه یک سیم سخت نیست و قادر است بدنبال آسیب بافتی ویا آسیب عصبی ویا افزایش زیاد در تحریکات آزار رسان تغییرات فانکشنال و ساختاری در آن ایجاد شود.این سازماندهی مجدد درمسیر نوسیسپتیو CNS به عنوان نوروپلاستیسیتی مرکزی شناخته میشود که در درجه اول بواسطه فعالیت نوسیسپتور الیاف C آغاز میشود.نرونهای ثانویه Wide dynamic range در ساب نئوکلئوس کادالیس تحت تاثیر قرار میگیرند و سبب میشود که آنها نسبت به محرک آزار رسان و غیر آزار رسان بیش از حد تحریک شوند.افزایش بیش از حد در تحریک پذیری CNS (سنترال سنسیتیزاسیون) مکانیسم مهم در اختلالات درد نروپاتیک مزمن و سوماتیک میباشند.برای تکامل سنترال سنسیتیزاسیون مهم است که مکانیسم های مهاری درد که از مراکز بالا منشائ میگیرند کاهش یابند. بعد از سنترال سنسیتیزاسیون نه تنها وقتی ایمپالسهای نوسیسپتیو به نرونهای ثانویه میرسند درد افزایش میابد بلکه یک محرک ضعیف مانند تماس خفیف (الیاف A بتا) میتواند پاسخهای آلودینیا را آغاز کند.توانایی فیبرهای A بتا برای ایجاد پاسخ دردناک به علت سازماندهی مجدد اتصالات عصبی در ساب نئوکلئوس کادالیس میباشد که دراین سازماندهی مجدد فیبرهای A بتا جوانه زده و داخل لامینا II که در حالت عادی توسط نوسیسپتورهای الیاف C اشغال شده است خاتمه میابد.در نتیجه این ساماندهی مجدد سیناپسهای فانکشنال جدید ایجاد شده که سبب میشود الیاف A بتا را قادر شوند که به نواحی گرفتار در انتقال محرکهای آسیب رسان دسترسی مستقیم داشته باشند.بعد از این حتی آسیب بی ضرر ممکن است باعث درد شدید و تیز گردد. سنترال سنسیتیزاسیون اثرات متعدد دیگری هم دارد: میتواند باعث افزایش فعالیت خود بخود شده و سبب افزایش Receptive field گردد که قادر میسازد که نرونهای ثانویه به نواحی وسیعی از محرکهای محیطی پاسخ دهند.این امر منجر میشود به انتشار درد به آنسوی مرزهای درماتومال گردد(هایپر آلژزیا ثانویه).اگر آسیب شدید باشد ممکن است باعث کاهش مکانیسمهای مهاری شود وسبب درد بیشتری گردد وحتی Receptive field میدان پذیرش بیشتری گردد.اگر چه سنترال سنسیتیزاسیون بعد از آسیب بافتی عمقی در عضله یا احشائ افزایش میابد،حتی مداومت یک اینپوت حسی ضعیف در محل ترومای محیطی به داخل CNS ممکن است برای حفظ وضعیت سنترال سنسیتیزاسیون کافی باشد .محتمل است که استعداد ژنتیکی یک فاکتور کمک کننده مهم در بروز سنترال سنسیتیزاسیون باشد شکل شش:الگوریتم سنترال سنسیتیزاسیون
همانطور که قبلا بیان شد التهاب نروژنیک در تکامل سنترال سنسیتیزاسیون نقش برجسته ای دارد.بدنبال آسیب بافتی یا محرکهای آسیب رسان طولانی مدت سوبستانس پی و CGRP همراه با دیگر نوروپپتیدها ،نوروکینین A و سوماتوستاتین میتوانند از طریق الیاف C آوران غیر میلینه(رفلکس آکسونی) به صورت مرکزی به نرون ثانویه در ساب نئوکلئوس کادالیس منتقل شوند.از اینرو این مواد نروشیمیایی میتوانند هماهنگ با نوروترانسمیترهای تحریکی (گلوتامات و آسپارتات) پروسه سنترال سنسیتیزاسیون را آغاز کنند. برای دسترسی به تصاویر و فایل ورد کیلک کنید.اینجانب از انتشار این فایلها و تکثیر آنها به هر صورت رضایت ندارم.تنها جهت خواندن شخص مراجعه کننده به سایت دکتر شوریابی در سایت بارگذاری شده است |
||
ارسال به دوستان

 تاریخ: جمعه 19 مرداد 1397 بازدید ها: 6813 دسته: مقالات علمی | |||||||||

.jpg)
.jpg)
.png)
.png)







.png) 09036111004 - 06133384746
09036111004 - 06133384746.png) Ahvazdentist_bot
Ahvazdentist_bot.png) خیابان اصلی کیانپارس،بین خیابان دوم وسوم غربی،ساختمان زرین.طبقه چهار واحد شانزده
خیابان اصلی کیانپارس،بین خیابان دوم وسوم غربی،ساختمان زرین.طبقه چهار واحد شانزده 